Hace ya unas semanas en la clase de Laboratorio se nos encomendó la tarea de realizar un trabajo acerca de vertidos industriales que modificasen el pH...
INTRODUCCIÓN
Según la Ley de Aguas, contaminación es la acción y el efecto de introducir materias o formas de energía, o inducir condiciones en el agua que, de modo directo o indirecto, impliquen una alteración perjudicial de su calidad en relación con los usos posteriores o con su función ecológica. Es decir, verter elementos contaminantes. Principalmente existen tres posibles tipos de vertidos en las aguas continentales según su origen. Son los siguientes:
· vertidos industriales
· vertidos urbanos
· vertidos de la agricultura y ganadería
pH en aguas
Las aguas naturales pueden tener pH ácidos por el CO2 disuelto desde la atmósfera o proveniente de los seres vivos; por ácido sulfúrico procedente de algunos minerales, por ácidos húmicos disueltos del mantillo del suelo. La principal substancia básica en el agua natural es el carbonato cálcico que puede reaccionar con el CO2 formndo un sistema tampón carbonato/bicarbonato.
Las aguas contaminadas con vertidos mineros o industriales pueden tener pH muy ácido. El pH tiene una gran influencia en los procesos químicos que tienen lugar en el agua, actuación de los floculantes, tratamientos de depuración, etc.
Consecuencias en medio marino (por ejemplo, en peces)
Los vertidos muy ácidos o alcalinos no deben descargarse sin tratamiento. Un curso de agua, previsto para tratar aguas residuales sin tratar, se altera de forma perjudicial por valores extremos del pH. Esta situación es aún más peligrosa cuando se producen descargas puntuales al curso de agua de ácidos o álcalis.
Cuando el pH es 6,5: tres especies diferentes de trucha muestran una reducción en el desove y el crecimiento.
Cuando el pH es 5,5: desaparición de los lucios y de una especia de trucha (arcoiris).
Cuando el pH es < 5: la mayoría de los peces no sobreviven.
Un pH tan bajo hace que las hembras de pez no desoven o, en caso de hacerlo, el pez sea muy sensible en las fases de huevo, larva y alevín. Un pH bajo puede interferir con el equilibrio de sales que las especies de agua dulce necesitan mantener en sus tejidos y plasma sanguíneo.
A pH considerados seguros, iones ácidos u otras especies pueden activar metales ya existenes, tales como el aluminio (tóxico para peces).
Existen varios métodos recomendados para neutralizar la gran acidez o alcalinidad de los vertidos industriales:
a- mezclar los vertidos de forma que se obtenga pH neutro
b- pasar los residuos ácidos a través de cal
c- mezclar vetidos ácidos con lechada de cal
d- añadir la proporción adecuada de soluciones concentradas de sosa cáustica o carbonato sódico a los vertidos ácidos
e- hacer pasar gas de combustión por vertidos alcalinos
f- añadir dióxido de carbono comprimido a los vertidos alcalinos
g- producir dióxido de carbono en vertidos alcalinos
h- añadir ácido sulfúrico a los vertidos alcalinos.
RÍA DE ABOÑO

Foto: ©Conde Ripoll
La presión industrial sobre la ría de Aboño es muy alta. Sus aguas con conocidas por su elevada contaminación. Entre las plantas contaminantes que la afectan
se encuentran la central térmica de Aboño, la fábrica de la metalúrgica Aceralia en Gijón, la cementera de Tudela Veguín y, justo en su desembocadura, el Parque de Carbones de la empresa Oligsa. Este Parque acumula el carbón a cielo abierto y no posee medidas de protección adecuadas. Por eso, las asociaciones de vecinos han denunciado en varias ocasiones la situación y exigido su cierre.

Foto: ©Conde Ripoll
Yo, apasionado por el mundo de las olas, frecuento este spot, pues para la práctica de bodyboard es un lugar espectacular. Además de por las olas, durante el invierno, cuando la temperatura de la superficie de las aguas ronda los 11-14ºC, en Aboño el agua está mucho más caliente y no es preciso ponerse un traje de neopreno 4/3mm (específico para la época invernal). A continuación, os muestro un vídeo que he encontrado por la red:
http://www.youtube.com/watch?v=M6fY1lvEq5g
He de decir que en numerosas ocasiones he visto estas aguas mucho más contaminadas...
Por otra parte, la ría de Navia es otra de las zonas que, siempre que voy a surfear a la costa gallega, observo que hay más contaminación en las aguas. Suele haber un manchurrón marrón de grandes dimensiones en la superficie marina que sale de la ría.
Otro ejemplo claro más cercano a mi casa es la playa de Peñarrubia, donde son frecuentes los vertidos de aguas residuales.

Playa de Peñarrubia. Foto: ©Conde Ripoll
PD: Para ver las fotos correctamente, pincha sobre ellas y ábrelas en una nueva pestaña












 Ahora una breve explicación de por qué ocurre esto:
Ahora una breve explicación de por qué ocurre esto: 





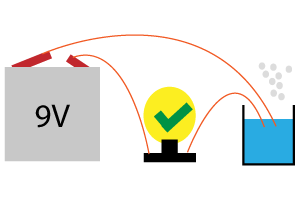




 Resultados de la medida de azúcar en refrescos
Resultados de la medida de azúcar en refrescos

 En otro orden de cosas, hoy se procederá a la compra de nuestra querida tortuga, que sucederá a los tritones como mascota de nuestro querido laboratio. Ya os daremos mas detalles en un breve periodo de tiempo.
En otro orden de cosas, hoy se procederá a la compra de nuestra querida tortuga, que sucederá a los tritones como mascota de nuestro querido laboratio. Ya os daremos mas detalles en un breve periodo de tiempo.