En la práctica de laboratorio de hoy, utilizamos una sencilla técnica para extraer ADN de tejido animal, o, en nuestro caso, tejido vegetal. Y así poder observar su estructura fibrilar.
Primeramente trituramos nuestra muestra con un mortero ayudados de arena, en nuestro caso elegimos una naranja (también disponíamos de plátano, pera, manzana... Y como tejido animal, hígado). De esta forma rompimos las paredes y membranas para que quedasen los núcleos sueltos.
Después a este triturado, le añadimos aproximadamente 50 centímetros cúbicos de agua y filtramos la ´papilla´resultante:
Tras esperar un rato a que se filtrase el contenido, este fue nuestro resultado:
A esta cantidad de filtrado le añadimos aproximadamente la misma cantidad de cloruro sódico 2M que nuestros compañeros habían preparado previamente. De esta forma, se produciría el estallido de los núcleos mediante un fenómeno de turgencia y las fibras de cromatina quedarían libres:
Cambiamos el contenido a un vaso más grande ya que el anterior se nos quedaba pequeño.Tras esto añadimos 2 gotas de detergente, cuya acción fue formar un complejo con las proteínas y separarlas del ADN
Tras el proceso anterior, añadimos alcohol ayudados de un cuentagotas, aproximadamente 50 centímetros cúbicos y con mucho cuidado de forma que el alcohol resbalase por las paredes:
Tras añadir el alcohol se formaban dos capas diferenciadas. Ayudados de una varilla removimos lentamente en la misma dirección para que se formasen las fibras blancas que corresponden a las fibras de cromatina.
Este fue nuestro resultado final, las fibras blancas que se aprecian en la parte superior son el resultado de la agrupación de muchas fibras de ADN.
El mejor resultado de todos, fue el del grupo que utilizó el plátano
ya que estas fibras eran mucho más visibles que en la naranja.


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)













+23.33.12.png)

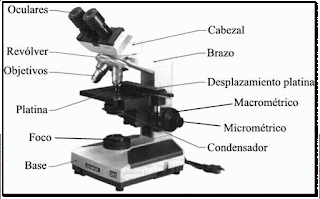 Microscopio
Microscopio Lupa
Lupa