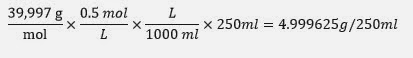miércoles, 16 de diciembre de 2015
Identidicación del almidón en alimentos
Vídeo realizado por Cinthya González Buric y Sofía Ibarra Vega
En este vídeo mostramos el proceso de deteccion de almidón en diversos alimentos; patata,galleta,pan y habas. Comprobamos que todos poseen almidón debido a que el iodo (lugol) pasa de un color rojizo a negro.
viernes, 27 de noviembre de 2015
Destilación del vino - Santi Maestro
Entre el 24 y 25 de Noviembre hemos realizado una destilación de vino. Las destilaciones sirven para separar 2 líquidos que tengan diferente punto de ebullición.
El vino se encuentra en el matraz, siendo calentado por el mechero de alcohol que tiene debajo. Mientras está destilando el alcohol la temperatura de ebullición de la muestra a calentar permanece constante, apróximadamente a 80ºC, en el momento que se termina el alcohol la temperatura sube y se debe detener el proceso de destilaciónn ya que empezaría a salir solo agua.
A medida que se va evaporando el alcohol del vino, sube hasta el conducto refrigerante, el cual tiene 2 conductos en su interior: Uno por donde circula el alcohol y otro por donde circula agua, el cual es conducido gracias a las gomas, entrando por la de la derecha y saliendo por la de la izquierda para que así con poca presión se llene el conducto entero.
La función del agua es enfriar el alcohol en estado gaseoso para que pase a ser alcohol en estado líquido y acabar en el vaso de muestra.
A medida que se va evaporando el alcohol del vino, sube hasta el conducto refrigerante, el cual tiene 2 conductos en su interior: Uno por donde circula el alcohol y otro por donde circula agua, el cual es conducido gracias a las gomas, entrando por la de la derecha y saliendo por la de la izquierda para que así con poca presión se llene el conducto entero.
La función del agua es enfriar el alcohol en estado gaseoso para que pase a ser alcohol en estado líquido y acabar en el vaso de muestra.
La muestra de alcohol destilado que obtuvimos fue de 44ml.
viernes, 13 de noviembre de 2015
ESPEJO DE PLATA
Primero diferentes compañeros hicieron las disoluciones, cuando estuvieron hechas, echamos en un tubo de ensayo dos dedos, más o menos, de nitrato de plata.
Después echamos un par de gotas de sosa (NaOH), y se agita hasta que quede marrón o negro.
Luego, echamos un par de gotas de amoníaco y se agita hasta que no quede precipitado.
Por último, se le echa el doble, de la disolución que tengamos en ese momento, de glucosa y se agita.
Por último, se le echa el doble, de la disolución que tengamos en ese momento, de glucosa y se agita.
Al acabar se le pone en el nombre con un permanente, al tubo de ensayo, y se calienta al baño. María, unos 20 minutos. Hasta que las paredes estén recubiertas del precipitado de plata. Después se saca el tubo y se tira el líquido.
Además realizamos un vídeo mientras echábamos el amoníaco en el tubo de ensayo:
Sara Soria e Inés Martín
EPIDERMIS CEBOLLA
Este es el vídeo que muestra los pasos de la práctica de la epidermis de la cebolla. Realizado por Cinthya González y Sofía Ibarra.
miércoles, 11 de noviembre de 2015
Observación de la epidermis de la cebolla
Esta práctica realizada durante la primera semana de
noviembre trataba de ser capaces de diferenciar las células de la capa de una
cebolla con ayuda del microscopio.
Para comenzar, debíamos de coger una capa muy fina para que
se pudieran ver las células con facilidad. Una vez cogida la capa, la dejamos
en remojo durante 5 minutos para que las células absorban el agua y
posteriormente en un tinte llamado azul de metileno durante 10 minutos para que
las tiña y así poder diferenciar sus células.
En esta imagen que tomamos con el microscopio (x40) se pueden
diferenciar las células y en algunas de ellas sus núcleos.
Al fin y al cabo, la
finalidad de esta práctica era obtener los conocimientos necesarios para ver
una muestra en el microscopio.
domingo, 8 de noviembre de 2015
Epidermis de cebolla
En esta práctica observamos la epidermis de la cebolla con la finalidad de ver al microscopio las células y sus núcleos.
Para comenzar separamos una capa muy fina de la cebolla y la tuvimos en agua para que las células se pusiesen turgentes debido al fenómeno conocido como ósmosis. Posteriormente le echamos azul de metileno para teñir las células y sus núcleos, esperamos diez minutos y la volvimos a bañar en agua de nuevo. Finalmente montamos la epidermis en el portaobjetos para observarla al microscopio.
lunes, 4 de mayo de 2015
Observación de las fases de la mitosis en las células de la raíz de la cebolla
Primeramente, para la
realización de este experimento, trajimos unas cebollas que introduciríamos en
unos vasos de precipitados con agua. Estas se sujetaban mediante palillos de
tal manera que la parte inferior del bulbo quedase bañada en agua a fin de que
creciesen sus raíces. Tras varios días observamos como en la cebolla había crecido mucho esas raíces y pudimos realizar la práctica.
 |
| La cebolla que utilizamos para extrae las muestras |
Para comenzar cogimos los extremos de estas raíces ya que es en los meristemos de las raíces donde se realiza la mitosis a fin de crecer. Cogimos un extremo de pequeño tamaño y lo pusimos en un vidrio de reloj. Sobre él vertimos unas dos gotas de orceína A a fin de que este quedase cubierto y posteriormente calentamos la muestra con un mechero de alcohol pero evitando que se secase la orceína A que cubría la raíz. Calentamos la muestra durante aproximadamente 8 minutos y después, con unas pinzas, la colocamos en un portaobjetos y le echamos una gota de orceína B. Tras ello cubrimos este portaobjetos con un cubreobjetos y aplastamos con cuidado la raíz para sacar toda la tinta sobrante y para después llevar la muestra al microscopio.
jueves, 30 de abril de 2015
Indicadores de pH caseros
El pasado día 9 de abril realizamos la practica de indicadores de pH caseros. Para realizar esta practica utilizamos las hojas de col de lombarda.
Primero tomamos un par de hojas, las cortamos y añadimos agua en una nota y las dejamos hervir durante 10 minutos en una cocina de camping que teníamos en el laboratorio. El resultado fue un liquido de color morado.
Con toda la cantidad de agua con lombarda que teníamos la dividimos en 6 partes iguales para que cada grupo tuviera la misma cantidad.
Mis compañeras y yo rellenamos 5 tubos de ensayo con aproximadamente tres dedos del agua con lombarda. En el primer tubo vertimos unas gotas de NaOH, CH3COOH, HCl, NH3 y H3PO4. Cada tubo cambio de color dependiendo del pH.
- En el 1º tubo vertidos unas gotas de NaOH, que es una base fuerte. El liquido paso a ser de color verde, lo que nos indica que tiene un pH de aproximadamente 12.
- En el segundo tubo añadimos unas gotas de vinagre, un ácido débil. El liquido paso a ser de color rosa, lo que nos india que el pH esta entre 4 y 6
- En el tercer tubo añadimos HCl, que es un ácido fuerte. El liquido paso a ser de color rojo lo que significa que el pH es menor de 2.
- En el cuarto tubo añadimos NH3 que es una base débil. El liquido paso a ser de color verde amarillento, por lo tanto el pH es 12 .
- En el quinto tubo añadimos H3PO4, que es un acido fuerte. El liquido paso a ser de color rojo lo que nos indica que el pH es menor de 2.
Arantza Muriel Garcia
miércoles, 29 de abril de 2015
ELECTRODEPOSICIÓN DE COBRE
En nuestro último día de laboratorio realizamos una práctica llamada electrodeposición del cobre. Ésta consistía en realizar un recubrimiento de cobre sobre algún objeto metálico como una llave, por ejemplo. Para este experimento requerimos de una pila de petaca, una lámina de cobre, una disolución de sulfato de cobre (CuSO4) 0,1 M y unos cables.
En el matraz erlenmeyer está la disolución de sulfato de cobre, la cual verteremos en un vaso de precipitados para sumergir tanto la plancha de cobre como la llave. ¿Por qué hacemos esto? Bueno, la respuesta es muy sencilla: en la disolución se encuentran los iones cobre que formarán la fina capa que recubrirá la llave. Esto sucede gracias a la acción que ejerce la corriente continua a la que están sometidas tanto la llave como la lámina.La llave se pondrá en contacto con la fuente de corriente continua, que es la pila, y con un electrodo que cumplirá la función de ánodo,la lámina de cobre, cediendo electrones para que los iones cobre de la disolución se reduzcan y se depositen sobre la llave, que cumple la función de cátodo. El ánodo, que es la lámina, se oxidará cediendo electrones y aportando iones cobre a la disolución a medida que los iones que ya estaban en la misma se depositen en la llave. De esta manera se produce poco a poco la fina capa de cobre que queremos obtener sobre la llave.
Para poder formar este circuito continuo usaremos los cables que habíamos mencionado antes. Uno para la unión de la llave con la solapa negativa de la pila, que es nuestro generador, y otro para la unión de la lámina con la solapa de la parte positiva.
Es muy importante que a la hora de sumergir la llave y la lámina de cobre éstas no se toquen en ningún momento.
La electrodeposición es uno de los procesos electroquímicos aplicado a nivel industrial, que tiene mayor importancia en cuanto a volumen de producción, y es también uno de los que causan mayor impacto económico, ya que se logra que piezas constituidas por material barato posea una gran resistencia a la corrosión. Algunos ejemplos son el zincado electrolítico y los procesos de estañado y cromado, entre otros.También se aplica en las joyerías para realizar esos recubrimientos de oro y plata.
lunes, 13 de abril de 2015
Valoración del Vinagre
Introducción:
El vinagre
es un producto natural que se obtiene del vino o la sidra por acción de unas
bacterias conocidas como Acetobacter aceti. Estos microorganismos oxidan el
etanol del vino o la sidra originales hasta convertirlo en ácido acético
(CH3-COOH). En esta práctica se pretende determinar el grado de acidez de un
vinagre, expresándolo en g/l de ácido acético.
Objetivo de la práctica:
Determinar el grado de acidez del vinagre.Fundamento teórico:
Se produce una reacción entre el ácido acético del vinagre y una disolución de hidróxido de sodio de concentración conocida. Este tipo de reacciones entre una base (hidróxido de sodio) y un ácido (acético en nuestro caso) se denominan neutralizaciones.Para conocer el momento exacto del fin de la neutralización, utilizamos un indicador de pH denominado fenolftaleína. Este pasa de incoloro (en un medio ácido) a rosa (en un medio básico).
La reacción que tendrá lugar es la siguiente: CH3-COOH + NaOH --> CH3-COONa + H2O
La
acidez se expresa en tanto por ciento en masa de ácido acético, lo que se llama
grado del vinagre.
Material y reactivos utilizados.
Materiales:
- Base y soporte.
- Nuez doble y pinzas de bureta.
- Matraz erlenmeyer de 250 mL.
- Matraz aforado de 250 mL.
- Pipeta aforada.
- Bureta de 50 mL.
Reactivos:
- Vinagre.
- Hidróxido de sodio.
- Fenoftaleína alcohólica al 0.1%
Procedimiento experimental:
- Realizamos los cálculos necesarios para realizar una disolución 0,5 M de sosa caustica.
- Con la pipeta aforada medimos 10 ml de vinagre y los vertemos en un Erlenmeyer que contenga 100 ml de agua. El agua no tiene que ser una cantidad precisa, ya que es para aumentar la superficie y poder apreciar el cambio de color de la fenolftaleína.
- Se añaden 3 o 4 gotas de fenolftaleína, el marcador de pH.
- Preparamos la bureta para recibir la disolución de sosa. La aclaramos por si quedan restos de anteriores prácticas. Cerramos la llave y la llenamos con un par de ml de sosa. Con esta cantidad procederemos a homogeneizarla, un proceso que consiste en impregnar de manera uniforme las paredes del instrumento con la sustancia en cuestión.
- Una vez realizada la homogenización descartamos esa sosa. Cargamos la bureta con una nueva cantidad de disolución y abrimos la llave para que llene también el espacio comprendido entre la misma y la pica.
- Cuando tenemos preparada la bureta, anotamos la marca en la que está situado el menisco.
- Abrimos lentamente la llave dejando caer gotas al Erlenmeyer mientras lo agitamos para asegurarnos de que los reactivos entran en contacto.
- Tras caer la primera gota que produzca un cambio de color de una duración mayor a los 30 segundos, cerramos la llave y anotamos la nueva cifra en la que este el menisco.
- Realiza los cálculos pertinentes para saber el volumen de disolución que se ha empleado en la neutralización.
- Repite el experimento para obtener otro resultado con el que hacer la media y obtener un resultado más preciso.
Cálculos y Operaciones:
·
Disolución de Sosa caustica 0,5M:
Masa Molecular Na(OH): 39,997 g/mol
· Cantidad de hidróxido de sodio gastada entre la lectura inicial y final:
1ª medida: 5.55-25.6= -20.05 (se gastaron 20.05 ml de
disolución 0,5 molar de sosa)
2ª medida: 13,2-33,2= -20 (se gastaron 20.05 ml de
disolución 0,5 molar de sosa)
Media ≈
20 ml
·
Conociendo los gramos de hidróxido de sodio
gastados, calcula cuántos gramos de ácido acético había en los 10 mL de vinagre
valorados.
Se gastaron 0,39997 gramos de sosa para neutralizar el ácido
acético. Como se trata de una neutralización 1 a 1, los gramos de sosa
utilizados serán los mismos que los gramos de ácido acético neutralizados. Por
consiguiente, en 10 ml de vinagre había 0,39997 gramos de ácido acético.
·
Sabiendo los gramos de ácido acético que hay en
10 mL de vinagre, calcula los que habrá en 100 mL.
En caso de que se pregunte los gramos de ác. Acético que
habrá en 100 ml de vinagre, serán 3,9997 gramos.
En caso de que la pregunta sea los gramos de ác. Acético
tras disolverlo en 100 ml de agua, la respuesta será: la misma cantidad ya que
lo que varía es la concentración no la cantidad de solutos.
·
Halla el grado de acidez de la muestra
analizada, es decir, los gramos de ácido acético que hay en 100 g de vinagre
(considera que la densidad del vinagre es aproximadamente la del agua d= 1 g/mL).
100 ml de vinagre≈
100 ml de vinagre
Si en 100 ml de vinagre hay 3,9997 gramos de ácido
acético, indica que su grado de acidez
es de 3,9º o 4º
Presentación de los resultados:
PRÁCTICA DE SOLUBILIDAD: REACCIONES DE PRECIPITACIÓN
Comenzamos la práctica realizando las diferentes
disoluciones que necesitábamos para realizar esta práctica (Cloruro sódico 0,2
M, Nitrato de plata 0,1 M, Cloruro de bario 0,1 M, Carbonato de sodio 0,1 M, Ácido
clorhídrico 0,25 M, Amoniaco 0,1 M), cada grupo nos encargábamos de realizar
una diferente para agilizar el proceso.
Empezamos vertiendo 5 ml de la disolución de cloruro sódico en
uno de los tubos, vimos cómo al añadir unas gotas de la disolución de nitrato
de plata se formaba un precipitado claramente visible porque la de la nueva
sustancia formada es mayor que su Kps y por eso precipita. Después fuimos
añadiendo a este mismo tubo gota a gota la disolución de amoníaco, observando
cómo se rediluía la mezcla porque la nueva sustancia que se originaba su Kps
era mayor que su Q.
Primer tubo de ensayo:
NaCl à Na + Cl , cuando se va introduciendo el AgNO3 à Ag + NO3 se mezcla por las reglas de
solubilidad el Ag con el Cl formándose la siguiente disolución: AgCl à Ag + Cl que precipita, se añade
entonces el NH3 à N2 + H2 y se forma por las reglas de
solubilidad HCl y se rediluye la mezcla.
En otro tubo de ensayo vertimos 5 ml de la disolución de
cloruro de bario y como habíamos hecho antes fuimos echando gotas de la
disolución de carbonato de sodio hasta que se formó un precipitado claramente
visible porque la Q de la nueva sustancia formada era mayor que su Kps y por eso precipitó. A continuación añadimos
la disolución de HCl y la disolución se rediluyó porque su Kps era menor que su
Q.
Fuimos sacando fotos durante todo el proceso, y cuando
finalizamos limpiamos bien los tubos de ensayo y recogimos todo lo que habíamos
usado para la práctica.
Segundo tubo de ensayo:
BaCl à Ba + Cl , cuando se va introduciendo el NaCO3 à Na + CO3 se mezcla por las reglas de solubilidad el Ba con el CO3 formando BaCO3 à Ba + CO3 que precipita, al introducir el HCl à H + Cl por las reglas de solubilidad reaccionan el CO3 con el H dando lugar al HCO3 que causará que se rediluya la mezcla.
lunes, 6 de abril de 2015
Videos realizados
Durante esta evaluación nuestro grupo: Olaya Salas, Arantza Muriel e Isabel Gonzalez, hemos realizado una serie de videos sobre algunas practicas realizadas en clase. Aquí os dejamos los videos para que los veáis:
-Uno de ellos es sobre la disección del corazón de cordero.
-Otro de la practica de equilibrio químico.
-Y finalmente el ultimo es sobre la practica de precipitados.
-Uno de ellos es sobre la disección del corazón de cordero.
-Otro de la practica de equilibrio químico.
-Y finalmente el ultimo es sobre la practica de precipitados.
Olaya Salas, Arantza Muriel e Isabel Gonzalez 2ºA
Equilibrio Químico
El pasado mes de marzo realizamos la practica de equilibrio químico, el objetivo era: Estudiar la evolución de un equilibrio químico cuando se varía la concentración de algunas de las sustancias intervinientes. Esta practica estaba relacionada con el principio de Le Chatelier que estudiamos en la asignatura de Química.
Para realizar esta practica utilizamos:
- Vasos de precipitados
- Cuatro tubos de ensayo
- Matraz aforado
- Agua
- Cuentagotas
- Disoluciones 0,1 M de FeCl3, KSCN, NaOH y de NaI
Entre los grupos de la asignatura nos dividimos las disoluciones, cada grupo calculo los gramos necesarios para realizar la disolución de 0,1 M en 250 ml a través de factores de conversión.
En un vaso de precipitado, preparamos una disolución en la que mezclamos 1 ml de la disolución de cloruro de hierro (III) y de tiocianato potasio, y 50 ml de agua. Con esta disolución, rellenamos cada tubo con la misma cantidad (4 en total).
- El primer tubo lo dejamos de control. Al haber realizado una disolución de 1 ml de cloruro de hierro, 1 ml de tiocianato potasio y 50 ml de agua, quedo un color rojizo.
- En el segundo añadimos unas gotas de KSCN y comprobamos que el equilibrio se desplazo hacia la derecha y la disolución se volvió de un color mas rojizo. Esto se debe a que al aumentar la cantidad de SCN, el equilibrio se desplaza hacia la derecha para compensar el exceso.
- En el tercer tubo, al añadir NaOH se formo un precipitado de hierro en el fondo, debido a que se hizo reaccionar hidróxido de sodio con el ión hierro. Al final, añadimos unas gotas de HCl, para hacer que el color de la disolución volviera a su estado inicial, y así fue.
- En el cuarto tubo, al añadir NaI, la disolución se volvió de color mas amarillenta. Esto se debe a que el equilibrio se desplazo hacia la izquierda
Arantza Muriel Garcia
domingo, 29 de marzo de 2015
Gametos de oricios.
El otro día en el laboratorio realizamos una práctica de extracción de gametos de oricios. Obtuvimos tanto espermatozoides como óvulos y observamos ambos al microscopio. Estas serían las dos imágenes que recogimos de ambos gametos en nuestro grupo. En el caso de los espermatozoides realizamos un vídeo para que se pudiera apreciar su movimiento.
Óvulos:
Espermatozoides:
Óvulos:
Espermatozoides:
lunes, 2 de marzo de 2015
Fecundacion in vitro de erizos de mar
ESTUDIO DE LA FECUNDACIÓN DEL ERIZO DE MAR (Paracentrotus lividus) EN CONDICIONES DE LABORATORIO.
jueves, 26 de febrero de 2015
ANEXO: Observación de un frotis Sanguíneo
ANEXO: Observación de un frotis Sanguíneo
Este es un anexo que añade al anterior post una serie de imágenes con mayor número de aumentos.
 Aumentos: x100 Aumentos: x100 | |||
Aumentos: x1600(Gota de Aceite) Nuestro grupo ha conseguido observar los glóbulos rojos(hematíes) con el mayor número de aumentos, en esta imágen se puede ver la ausencia de núcleo de estos. También se puede apreciar en el inferior de la imágen unos linfocitos, debido aque poseen núcleo.
Imágenes tomadas por: Sergiy Vasatyuk y Diego Sanz Yus.
miércoles, 18 de febrero de 2015
Observación de un frotis sanguíneo.
El último experimento que realizamos en el laboratorio fue la preparación de un frotis sanguíneo para su posterior observación al microscopio.
Lo primero que hicieron algunos de los compañeros fue pincharse en el dedo con una aguja esterilizada para obtener unas gotas de sangre que supondrían la muestra a observar.
Dispusimos estas gotas de sangre en portaobjetos y dejamos que esta se secara. A continuación añadimos alcohol a la muestra y dejamos que se evaporara. Después añadimos Hematoxilina que dejamos reposar por 15 minutos y por último Eosina, que tan sólo dejamos 1 minuto.
Tras la preparación fuimos a los microscopios a observar nuestra muestra y estas fueron las imágenes que pudimos ver:
Microscopio óptico 40x16 y fotos tomadas con la cámara de un dispositivo móvil:
viernes, 6 de febrero de 2015
CALORIMETRÍA
La última práctica que hemos realizado ha sido sobre la termoquímica, la neutralización del NaOH y éstos han sido los resultados. Como se puede comprobar, han sido satisfactorios ya que se puede apreciar el aumento de temperatura en cuanto al tiempo transcurrido de la reacción y una vez concluída, la estabilización de la temperatura.
BY: DIEGO Y sergiy
sábado, 24 de enero de 2015
LA DESTILACIÓN
Este diciembre realizamos la destilación
que se basa en separar mezclas de dos líquidos con distintos puntos de
ebullición. Para separar los dos líquidos hay que calentar la mezcla y esta
empezará a hervir cuando llegue a la temperatura del punto de ebullición del
elemento que más bajo lo tenga, (por ejemplo con el agua y el alcohol a 80ºC el
alcohol alcanza su punto de ebullición y se empezará a evaporar quedando sólo
el agua).
.jpg) Para realizar nuestra destilación
primero colocamos un trípode dónde apoyamos un matraz de balón en el que echamos
vino de tetrabrick. Debajo del trípode pusimos un mechero de alcohol para
calentar el vino. Con un soporte sujetamos una pieza de vidrio con dos uniones
cónicas de vidrio esmerilado. La primera unión encajaba por arriba con el final
del termómetro hecho también de vidrio esmerilado. De la segunda unión (que se
encontraba a la derecha) encajamos el tubo de refrigerio, el cual tenía dos
aberturas de las que salían dos gomas hacia el fregadero, por una de ellas
entraba el agua para enfriar y por la otra salía. El tubo de refrigerio
constaba de dos partes una de ellas con forma serpenteante dentro de la otra
por donde corría el agua que enfriaba el alcohol evaporado y hacía que pasara a
estado líquido otra vez, y otra parte por la que pasaba el vapor del alcohol
que se iba condensando.
Para realizar nuestra destilación
primero colocamos un trípode dónde apoyamos un matraz de balón en el que echamos
vino de tetrabrick. Debajo del trípode pusimos un mechero de alcohol para
calentar el vino. Con un soporte sujetamos una pieza de vidrio con dos uniones
cónicas de vidrio esmerilado. La primera unión encajaba por arriba con el final
del termómetro hecho también de vidrio esmerilado. De la segunda unión (que se
encontraba a la derecha) encajamos el tubo de refrigerio, el cual tenía dos
aberturas de las que salían dos gomas hacia el fregadero, por una de ellas
entraba el agua para enfriar y por la otra salía. El tubo de refrigerio
constaba de dos partes una de ellas con forma serpenteante dentro de la otra
por donde corría el agua que enfriaba el alcohol evaporado y hacía que pasara a
estado líquido otra vez, y otra parte por la que pasaba el vapor del alcohol
que se iba condensando.  Al final del refrigerador colocamos otra pieza de
vidrio con una unión de rótula de vidrio esmerilado, esta pieza acababa en el
erlenmeyer, dónde caían las gotas de alcohol que se iban separando de la
mezcla. Unimos las piezas con gomitas y las sujetábamos con los soportes de los
que disponíamos.
Al final del refrigerador colocamos otra pieza de
vidrio con una unión de rótula de vidrio esmerilado, esta pieza acababa en el
erlenmeyer, dónde caían las gotas de alcohol que se iban separando de la
mezcla. Unimos las piezas con gomitas y las sujetábamos con los soportes de los
que disponíamos. Queríamos separar el alcohol del agua de una cierta cantidad de vino (el otro grupo lo hizo con sidra en un
equipo de destilación más pequeño). Al empezar a calentar el vino el alcohol se
empezó a evaporar a unos 80 grados mientras quedaba el agua en el matraz de
balón. El vapor del alcohol pasaba al tubo de refrigeración y así volvía a
pasara estado líquido al condensarse para acabar cayendo en forma de gotas en
el erlenmeyer quedando así separado el agua del alcohol del vino. La primera
gota de alcohol cayó en el erlenmeyer a una temperatura de 80ºC que medimos con
el termómetro.
Queríamos separar el alcohol del agua de una cierta cantidad de vino (el otro grupo lo hizo con sidra en un
equipo de destilación más pequeño). Al empezar a calentar el vino el alcohol se
empezó a evaporar a unos 80 grados mientras quedaba el agua en el matraz de
balón. El vapor del alcohol pasaba al tubo de refrigeración y así volvía a
pasara estado líquido al condensarse para acabar cayendo en forma de gotas en
el erlenmeyer quedando así separado el agua del alcohol del vino. La primera
gota de alcohol cayó en el erlenmeyer a una temperatura de 80ºC que medimos con
el termómetro.Disección al corazón en fotos.
El día 22, en el laboratorio, hicimos una disección a un corazón de cerdo para poder estudiar las partes y el funcionamiento de este órgano de forma más directa y divertida.
En estas imagenes podemos ver lo primero que nos encontramos una vez que hacemos la incisión en el órgano y lo abrimos. En la parte superior se pueden distinguir las arterias aorta y pulmonar:
A continuación, cortando un poco más, podemos observar la pared muscular que recubre internamente el corazón
Y en la parte superior, debajo de la arteria aorta, las válvulas que impiden el retroceso de la sangre, las cuales se asemejan a una fina capa de tejido:
Finalmente, después de identificar todas las partes del corazón y trastear un poco con los tejidos y paredes, finalizamos el experimento con ganas de repetir o hacer otro similar en un futuro.
En estas imagenes podemos ver lo primero que nos encontramos una vez que hacemos la incisión en el órgano y lo abrimos. En la parte superior se pueden distinguir las arterias aorta y pulmonar:
A continuación, cortando un poco más, podemos observar la pared muscular que recubre internamente el corazón
Y en la parte superior, debajo de la arteria aorta, las válvulas que impiden el retroceso de la sangre, las cuales se asemejan a una fina capa de tejido:
Finalmente, después de identificar todas las partes del corazón y trastear un poco con los tejidos y paredes, finalizamos el experimento con ganas de repetir o hacer otro similar en un futuro.
DISECCIÓN DE UN CORAZÓN DE CERDO
El pasado jueves 22, hemos realizado una disección del corazón. A cada pareja se nos ha repartido una bandeja de disección, un bisturí y una tijeras, además de un corazón. Para comenzar, lavamos los corazones para eliminar restos de sangre coagulada y otras cosas. Observamos el corazón desde todos sus ángulos hasta encontrar la posición habitual del mismo con ayuda de una maqueta y un póster.Lo primero, tuvimos que reconocer todas las arterias y venas principales, además de reconocer cuál era cada una y explicar los dos tipos de circulación humana: la circulación mayor y la menor. Una vez encontradas todas las salidas y entradas, realizamos un corte por encima de la veta, perfectamente visible, para ver el interior del corazón y encontrar sus válvulas. Pudimos distinguirlas difícilmente debido al estado del corazón, pero pudimos ver el tejido muscular, miocardio, y la gran capa de músculo que separa la parte derecha de la parte izquierda.
Como ya sabemos, el corazón presenta una aurícula derecha, una aurícula izquierda, un ventrículo izquierdo y un ventrículo derecho.
Hicimos un pequeño vídeo rápido sobre la disección, que espero que disfrutéis a no ser que os de cosilla la sangre y esas cosas.
El pasado jueves 22, hemos realizado una disección del corazón. A cada pareja se nos ha repartido una bandeja de disección, un bisturí y una tijeras, además de un corazón. Para comenzar, lavamos los corazones para eliminar restos de sangre coagulada y otras cosas. Observamos el corazón desde todos sus ángulos hasta encontrar la posición habitual del mismo con ayuda de una maqueta y un póster.Lo primero, tuvimos que reconocer todas las arterias y venas principales, además de reconocer cuál era cada una y explicar los dos tipos de circulación humana: la circulación mayor y la menor. Una vez encontradas todas las salidas y entradas, realizamos un corte por encima de la veta, perfectamente visible, para ver el interior del corazón y encontrar sus válvulas. Pudimos distinguirlas difícilmente debido al estado del corazón, pero pudimos ver el tejido muscular, miocardio, y la gran capa de músculo que separa la parte derecha de la parte izquierda.
Como ya sabemos, el corazón presenta una aurícula derecha, una aurícula izquierda, un ventrículo izquierdo y un ventrículo derecho.
lunes, 19 de enero de 2015
PRÁCTICAS DE LA EXTRACCIÓN DEL ADN
Esta fue la última práctica que realizamos. El objetivo era poder extraer el ADN de un tejido animal y confirmar su estructura fibrilar y confirmar también que el núcleo del ADN se encuentra replegado.
Utilizamos mandarina para realizar esta práctica.
Comenzamos triturando dos gajos
de mandarina en un mortero. Luego le añadimos una cantidad no muy grande de agua, y
a continuación echamos también arena para que así se rompiesen mejor las
membranas de la célula de la mandarina y quedasen los núcleos sueltos, para ello removimos, y una vez que nos había quedado la
mezcla con la apariencia de papilla echamos un poco más de agua para que
quedara más líquida, y cogimos el embudo y un filtro de café, lo colocamos en
un soporte con un vaso debajo y añadimos la mezcla al embudo para que se
filtrase separando así los restos de tejido que habían quedado por romper.
Una vez que teníamos una cantidad
considerable filtrada lo pasamos a un tubo de ensayo y le echamos la misma
cantidad de una disolución de cloruro sódico 2M consiguiendo así producir la
rotura de los núcleos para que quedasen libres las fibras de cromatina.
A continuación añadimos a la
mezcla una gota de fairy para que así se formara un complejo con las proteínas
y las separara del ADN para que este quedase visible, y quedasen el ADN y las
proteínas que tiene asociadas separadas.
Después añadimos un poco de alcohol que íbamos echando muy despacio de forma que
este resbale por las paredes del vaso y se formen dos capas. En la interfase,
precipitará el ADN y será lo que debemos observar.
Pero antes de poder observar
estas fibras tuvimos que Introducir una varilla de vidrio e ir removiendo
siempre en la misma dirección. Sobre la varilla se van adhiriendo unas fibras
blancas, visibles a simple vista, que son el resultado de la agrupación de
muchas fibras de ADN,
Este fue el resultado que obtuvimos dónde se pueden observar las fibras de ADN:
sábado, 10 de enero de 2015
Azucares reductores
El pasado 26 de noviembre realizamos la practica de los azucares reductores. Mediante esta practica pretendíamos identificar la presencia de azucares reductores como la maltosa, sacaros, glucosa, fructosa y almidón en diferentes disoluciones y muestras de alimentos.
Para las disoluciones utilizamos tubos de ensayo, un mechero de alcohol y lo mas importante el reactivo de Fehling A y B. En los tubos echamos un poco de glucosa, azúcar, leche, miel y jugo de mandarina junto a 5 ml de agua, después en cada uno echamos 5 ml de reactivo de Fehling A y B y lo calentamos con el mechero de alcohol. En todos ellos se cambio de color ya que la disolución contenía un disacárido reductor que reduce el reactivo de Fehling.
Pero en uno de ellos, el que contenía azúcar, no se produjo este cambio, eso se debe a que contiene sacarosa que es el único glucido que no reduce el reactivo de Fehling. Para hacer que se redujera echamos unas gotitas de acido clorhídrico y volvimos a echar el reactivo de Fehling A y B. Finalmente lo calentamos y cambio de color, también lo realizamos con saliva, ya que en ella tenemos unas enzimas que también rompen los lucidos de la sacaros y reduce el reactivo.
Dos dias después realizamos esta misma practica con comida. Intentamos comprobar cual de los alimentos poseían verdaderamente almidón. Para ello utilizamos betadine, esto se debe a que el almidón tiene una propiedad de reaccionar con el yodo tomando un color azul oscuro. En la comprobación obtuvimos como resultado que la galleta, el chope, el pan, el arroz y la patata poseían almidón pero los garbanzos y las lentejas no.
Suscribirse a:
Entradas (Atom)





.jpg)